Premio Nobel de Fisiología o Medicina 2025: cómo se mantiene el sistema inmunológico bajo control
6 Outubro 2025
Escrito por Francisco H. C. Felix
Fuente: Nobel Prize Outreach 2025
Mary E. Brunkow, Fred Ramsdell y Shimon Sakaguchi fueron galardonados con el Premio Nobel de Fisiología o Medicina 2025 “por sus descubrimientos sobre la tolerancia inmune periférica”. Las investigaciones de los galardonados aclararon cómo el sistema inmunológico evita atacar los propios tejidos del cuerpo —un mecanismo esencial para prevenir enfermedades autoinmunes— a través de un subconjunto especializado de linfocitos T, hoy conocidos como células T reguladoras (Tregs Treg: abreviatura de células T reguladoras: un subconjunto de linfocitos T cuya función principal es suprimir respuestas inmunes excesivas o autorreactivas. Las Tregs mantienen la tolerancia periférica y previenen daños colaterales en los tejidos mediante múltiples mecanismos celulares y moleculares. ).
Resumen de los descubrimientos
Mary E. Brunkow — Doctora por Princeton; trabajo clave identificando mutaciones que conducen a la pérdida de tolerancia inmunológica en modelos animales; actualmente vinculada al Institute for Systems Biology, Seattle, EE. UU.
Fred Ramsdell — Doctorado (UCLA); contribuciones centrales en la identificación del gen FOXP3 y su relación con fenotipos de autoinmunidad; trabaja como consultor científico/empresarial en biotecnología.
Shimon Sakaguchi — M.D./Ph.D. (Universidad de Kyoto); descubrió el papel de las Tregs en la tolerancia periférica y demostró cómo su ausencia o disfunción conduce a la autoinmunidad; profesor en el Immunology Frontier Research Center, Universidad de Osaka, Japón.
Shimon Sakaguchi realizó el primer hallazgo decisivo en 1995 al identificar un grupo de células T con función reguladora —células que limitan respuestas inmunes potencialmente dañinas. Posteriormente, Mary Brunkow y Fred Ramsdell identificaron la mutación responsable de un fenotipo autoinmune en ratones (el gen FOXP3) y demostraron que alteraciones en el gen homólogo en humanos causan síndromes autoinmunes graves (p. ej., IPEX). La conexión entre FOXP3 y el desarrollo/funcionamiento de las Tregs consolidó un nuevo campo de investigación: la tolerancia periférica.
El trabajo de los galardonados cambió nuestra comprensión sobre los mecanismos que impiden que el sistema inmunológico ataque al propio organismo. Las implicaciones son vastas: la manipulación de las Tregs es hoy una estrategia prometedora tanto en enfermedades autoinmunes (donde se busca reforzar la tolerancia) como en oncología (donde puede ser necesario atenuar la acción de estas células para mejorar la respuesta antitumoral). Además, los avances en tolerancia inmunológica pueden hacer los trasplantes más seguros y reducir la necesidad de inmunosupresión crónica.
Piense en el sistema inmune como un ejército cuya función es proteger el cuerpo. Para evitar daños colaterales (por ejemplo, atacar células propias), además de entrenar a los soldados para reconocer enemigos, el cuerpo cuenta con oficiales de supervisión —las Tregs—. Actúan como un freno: cuando la respuesta inmune es demasiado fuerte o dirigida contra lo propio, las Tregs intervienen y disminuyen la reacción.
Los descubrimientos premiados muestran:
1) que existe un tipo específico de célula cuya función principal es suprimir respuestas peligrosas fuera del lugar de formación primaria (la llamada tolerancia periférica); 2) que un gen llamado FOXP3 es esencial para que estas células existan y funcionen correctamente. Sin FOXP3, el sistema pierde el freno y se producen ataques contra lo propio (enfermedades autoinmunes).
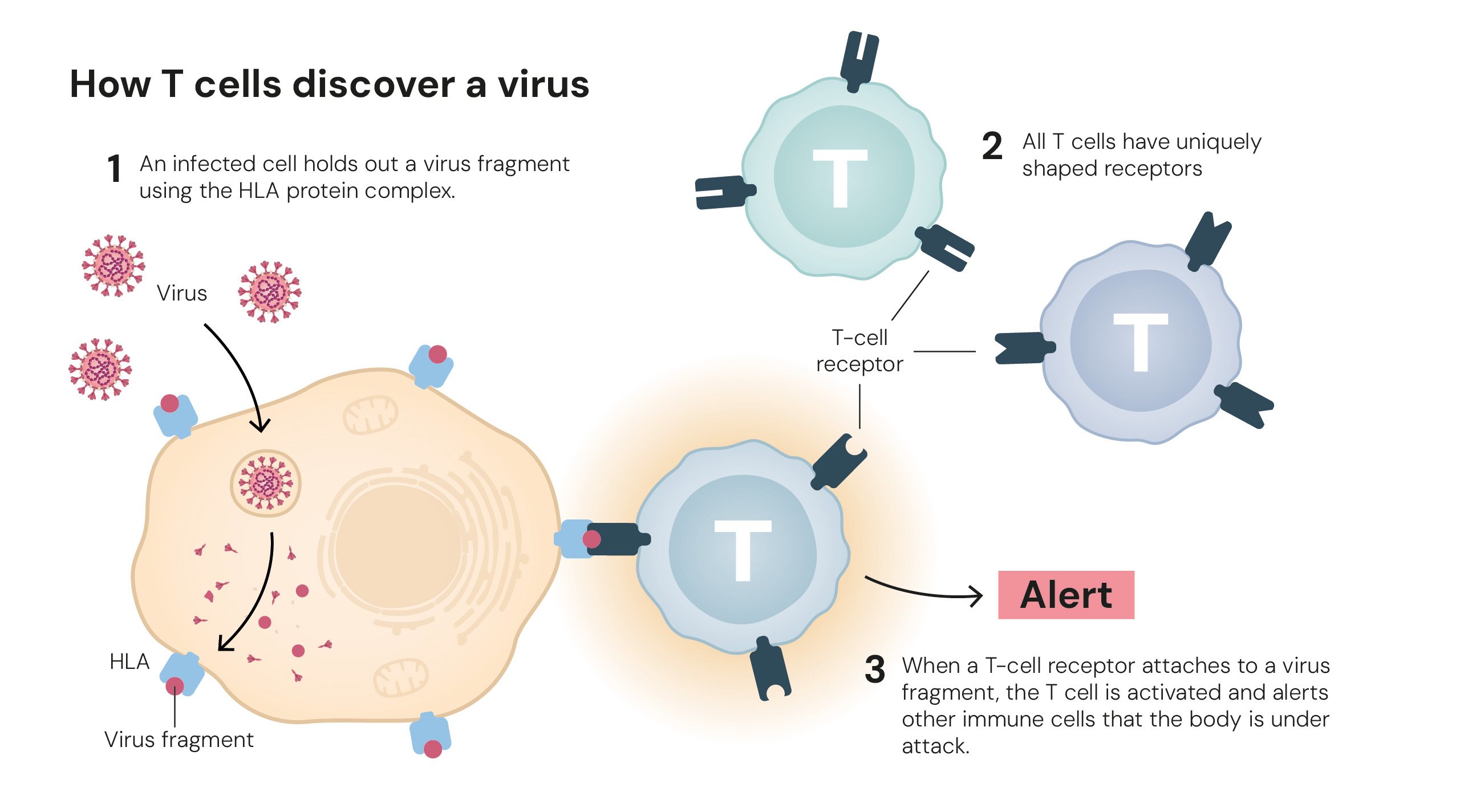
Cómo las células T encuentran un virus. Ilustraciones: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
Las Tregs más estudiadas son CD4+CD25+FOXP3+. FOXP3 FOXP3: gen que codifica un factor de transcripción esencial para el desarrollo y la función de las células T reguladoras (Tregs). Mutaciones que provocan pérdida de función en FOXP3 provocan fallo de la tolerancia inmunitaria, asociado a síndromes autoinmunes graves (p. ej., IPEX en humanos) y al fenotipo “scurfy” en ratones.
es el factor de transcripción que programa el destino y la función supresora de estas células. Existen mecanismos de tolerancia central (en el timo) y de tolerancia periférica (fuera del timo) Tolerancia central vs periférica: la tolerancia central ocurre en el timo durante la maduración de las células T, donde se eliminan clones altamente autorreactivos; la tolerancia periférica agrupa los mecanismos fuera del timo que controlan linfocitos autorreactivos residuales, incluyendo la acción de las Tregs. . Sakaguchi y otros demostraron que parte de la población reguladora se genera en el timo, pero que también existen Tregs inducidas en la periferia a partir de células T convencionales bajo ciertas señales (TGF-β, IL-2). Mecanismos de supresión: las Tregs usan múltiples mecanismos —producción de citocinas antiinflamatorias (IL-10, TGF-β), expresión de CTLA-4 que modula a las células presentadoras de antígeno, consumo local de IL-2 (privando a otras células) y alteración metabólica del microambiente (p. ej., producción de adenosina vía CD39/CD73). Mecanismos de las Tregs: las células T reguladoras suprimen las respuestas inmunes mediante varios mecanismos — secreción de citocinas inhibitorias (IL-10, TGF-β), alteración metabólica de células T efectoras, modulación de la función de las células dendríticas y citólisis directa en algunos contextos. La importancia relativa depende del tejido y del tipo de respuesta inmune.
Los estudios de transferencia celular, modelos de ratón con deleción de FOXP3 (fenotipo “scurfy” en ratones Ratón scurfy: modelo animal con mutación de pérdida de función en Foxp3 que desarrolla una autoimmunidad linfoproliferativa mortal en vida temprana; este modelo fue clave para demostrar el papel esencial de FOXP3 y las Tregs en la tolerancia inmunitaria. ) y hallazgos clínicos en IPEX (síndrome humano asociado a mutaciones en FOXP3) fueron cruciales para establecer la relación causal.
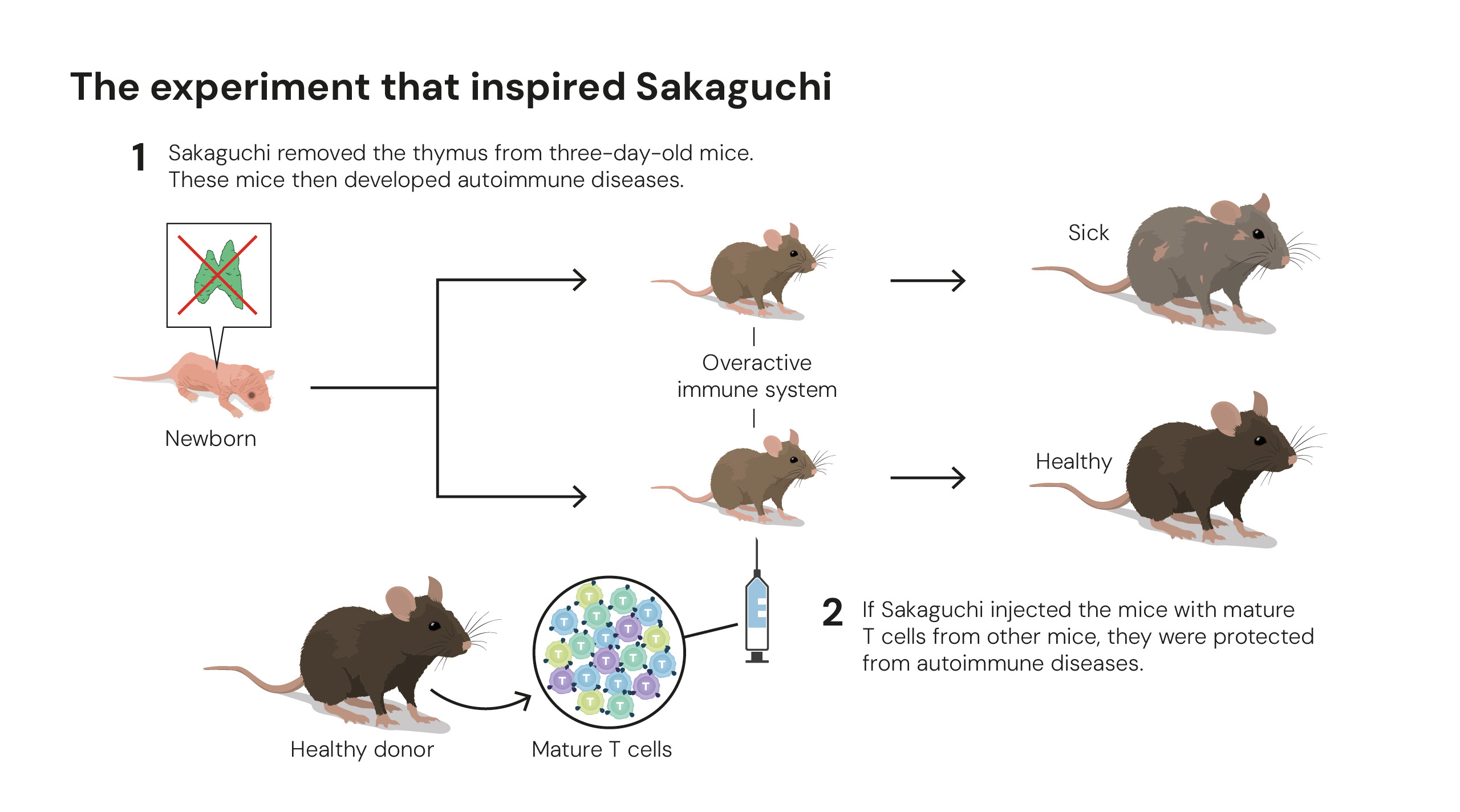
Experimento que inspiró estudios sobre tolerancia periférica. Ilustraciones: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
Implicaciones clínicas y aplicaciones
Autoinmunidad: comprender las Tregs y FOXP3 permite identificar causas de síndromes como IPEX, además de señalar estrategias para restaurar la tolerancia en enfermedades autoinmunes (artritis reumatoide, esclerosis múltiple, diabetes tipo 1).
Oncología: los tumores con frecuencia reclutan o inducen Tregs para suprimir respuestas antitumorales; modular las Tregs puede mejorar la eficacia de inmunoterapias (inhibidores de puntos de control, vacunas).
Trasplantes: las terapias basadas en Tregs (infusión de Tregs, protocolos para expandirlas) se están probando para reducir el rechazo y disminuir el uso de inmunosupresores de amplio espectro.
Terapéuticas emergentes: los enfoques incluyen la expansión ex vivo de Tregs, la ingeniería de Tregs con receptores específicos (CAR-Tregs) y fármacos que modulan vías clave (IL-2 de baja dosis para favorecer las Tregs CAR-Tregs: células T reguladoras modificadas con receptores quiméricos de antígeno (CAR) son una estrategia terapéutica experimental en la que las Tregs se diseñan para reconocer antígenos específicos y dirigir su actividad supresora hacia tejidos o dianas concretas (aplicaciones en autoinmunidad y trasplante). ).
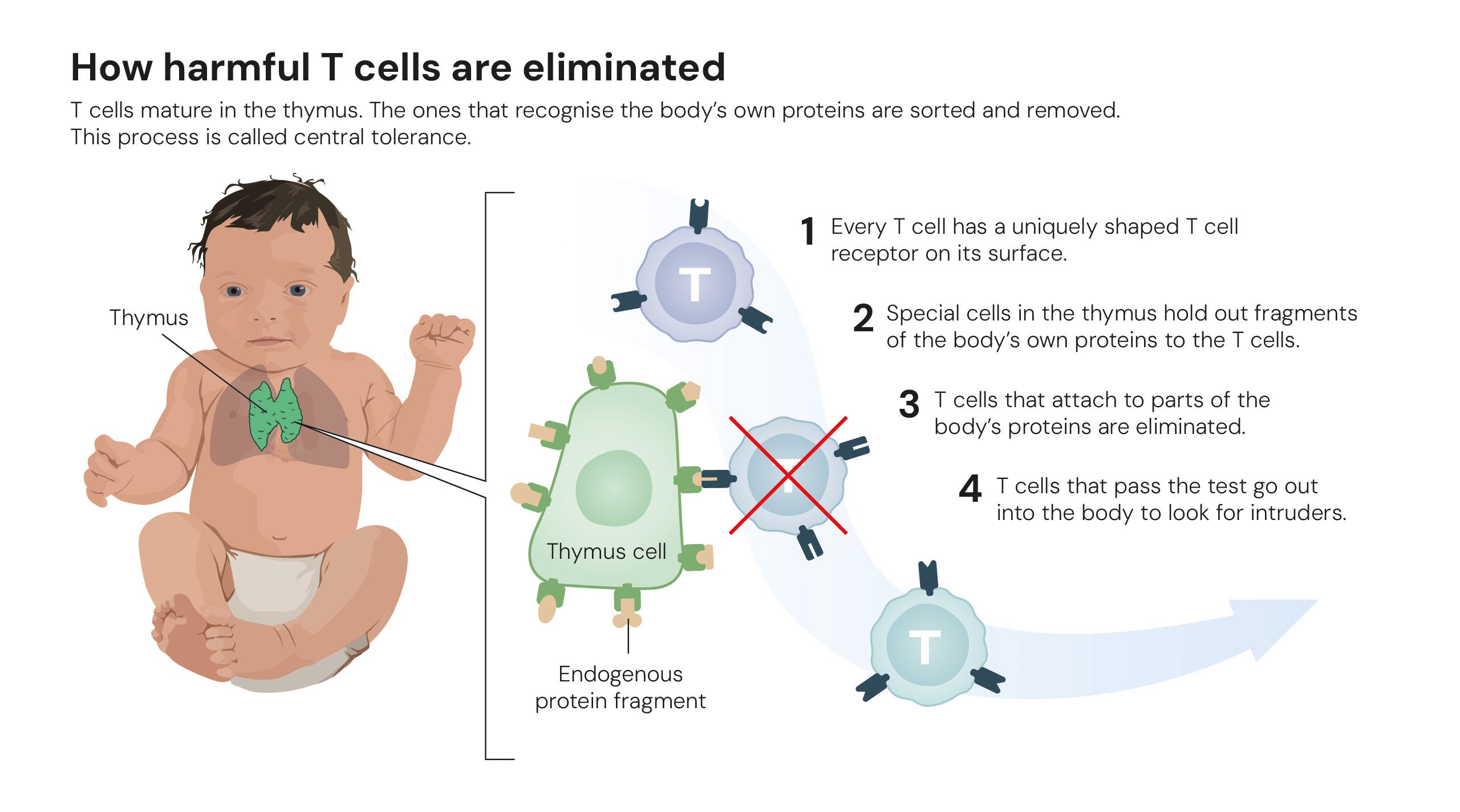
Cómo se eliminan las células T dañinas. Ilustraciones: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
Lea más
La principal fuente de esta publicación es el comunicado de prensa de la Fundación Nobel y los materiales de apoyo publicados por Nobel Prize Outreach (comunicado oficial, antecedentes científicos y resumen para público general).
Referencias
Resumen para público general, Asamblea Nobel - en inglés (pdf)
Antecedentes científicos, Asamblea Nobel - en inglés (pdf)