Prêmio Nobel de Fisiologia ou Medicina 2025: como o sistema imune é mantido sob controle
6 Outubro 2025
Escrito por Francisco H. C. Felix
Fonte: Nobel Prize Outreach 2025
Mary E. Brunkow, Fred Ramsdell e Shimon Sakaguchi foram agraciados com o Prêmio Nobel de Fisiologia ou Medicina de 2025 “por suas descobertas sobre a tolerância imune periférica”. As pesquisas dos laureados elucidaram como o sistema imune evita atacar os próprios tecidos do corpo — um mecanismo essencial para prevenir doenças autoimunes — através de um subconjunto especializado de linfócitos T, hoje conhecidos como células T reguladoras (Tregs) Treg: abreviação de “células T reguladoras” — um subconjunto de linfócitos T cuja função principal é suprimir respostas imunes exageradas ou auto-reativas. As Tregs mantêm a tolerância periférica e evitam danos colaterais ao tecido, usando múltiplos mecanismos celulares e moleculares. .
Resumo das descobertas
Mary E. Brunkow — Ph.D. por Princeton; trabalho chave identificando mutações que levam à perda de tolerância imune em modelos animais; atualmente associada ao Institute for Systems Biology, Seattle, EUA.
Fred Ramsdell — Ph.D. (UCLA); contribuições centrais para a identificação do gene FOXP3 e sua relação com fenótipos de autoimunidade; atua como consultor científico/empresarial em biotecnologia.
Shimon Sakaguchi — M.D./Ph.D. (Kyoto University); descobriu o papel das Tregs na tolerância periférica e demonstrou como sua ausência ou disfunção leva à autoimunidade; professor no Immunology Frontier Research Center, Osaka University, Japão.
Shimon Sakaguchi fez a primeira descoberta decisiva em 1995 ao identificar um grupo de células T com função reguladora — células que limitam respostas imunes potencialmente danosas. Posteriormente, Mary Brunkow e Fred Ramsdell identificaram a mutação responsável por um fenótipo de autoimunidade em camundongos (o gene FOXP3 FOXP3: gene que codifica um fator de transcrição fundamental para o desenvolvimento e a função das células T reguladoras (Tregs). Mutações loss-of-function em FOXP3 resultam em perda da tolerância imunológica, associadas a síndromes graves de autoimunidade (por exemplo, IPEX em humanos) e ao fenótipo “scurfy” em camundongos. FOXP3 controla programas de expressão gênica que conferem propriedades supressoras às Tregs. ) e demonstraram que alterações no gene homólogo em humanos causam síndromes autoimunes graves (ex.: IPEX IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked): síndrome humana rara causada por mutações em FOXP3. Caracteriza-se por autoimunidade precoce, enteropatia grave, endocrinopatias e outras manifestações autoimunes; frequentemente inicia na infância e tem curso sério sem tratamento adequado. ). A ligação entre FOXP3 e o desenvolvimento/funcionamento das Tregs consolidou um novo campo de investigação: a tolerância periférica.
O trabalho dos laureados mudou nossa compreensão sobre os mecanismos que impedem o sistema imune de atacar o próprio organismo. As implicações são vastas: a manipulação de Tregs é hoje uma estratégia promissora tanto em doenças autoimunes (onde se busca reforçar a tolerância) quanto em oncologia (onde pode ser preciso atenuar a ação dessas células para melhorar a resposta antitumoral). Além disso, avanços na tolerância imunológica podem tornar transplantes mais seguros e reduzir a necessidade de imunossupressão crônica.
Pense no sistema imune como um exército cuja função é proteger o corpo. Para evitar danos colaterais (por exemplo, atacar células do próprio corpo), além de treinar soldados para reconhecer inimigos, o corpo tem oficiais de fiscalização — as Tregs. Elas atuam como um freio: quando a resposta imune é forte demais ou dirigida contra as próprias células, as Tregs intervêm e diminuem a reação.
As descobertas premiadas mostram:
1) que existe um tipo específico de célula cuja função principal é suprimir respostas perigosas fora do centro de formação de células (a chamada tolerância periférica); 2) que um gene chamado FOXP3 é essencial para que essas células existam e funcionem corretamente. Sem FOXP3, o sistema perde o freio e ataques ao próprio corpo ocorrem (doenças autoimunes).
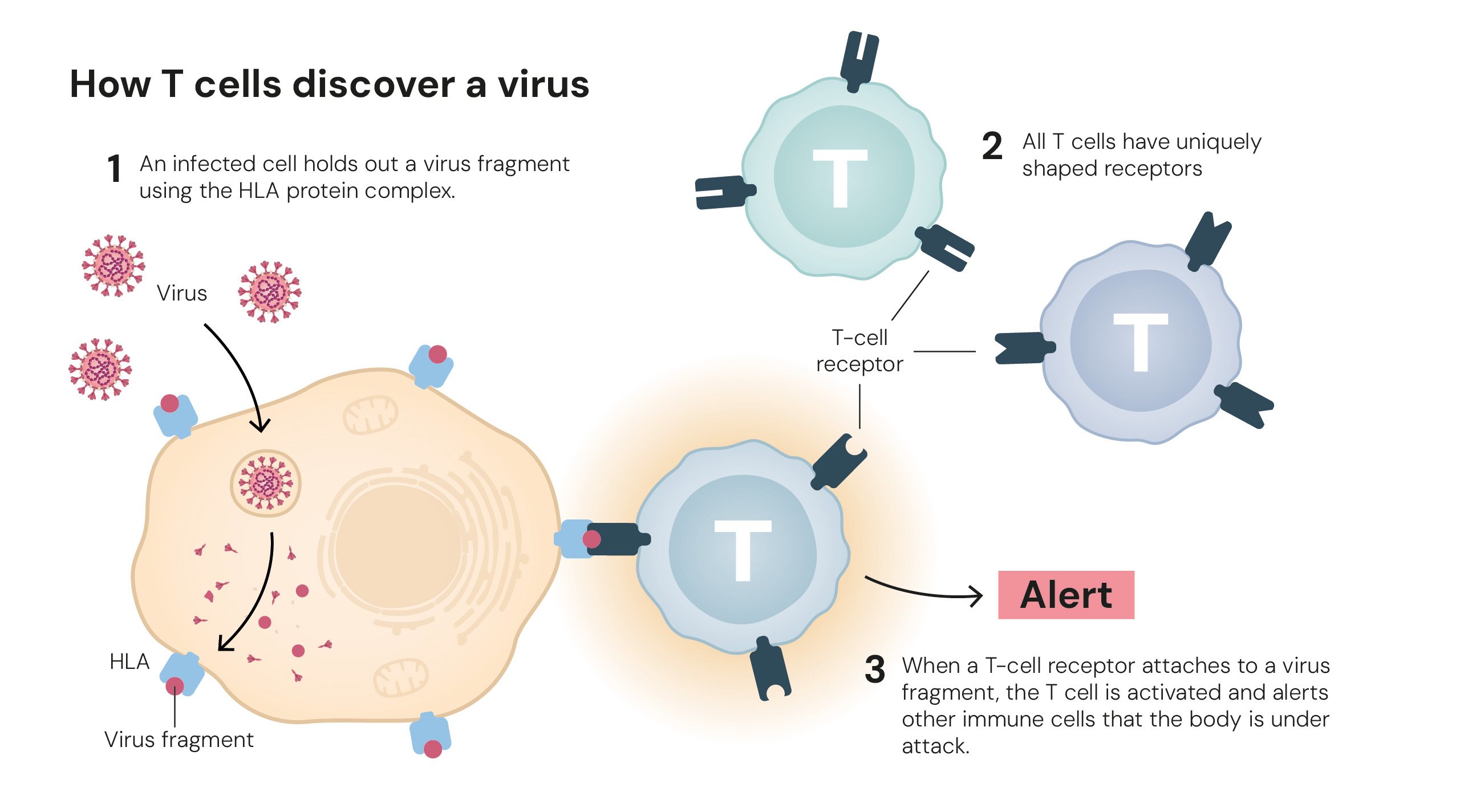
Como T cells descobrem um vírus. Ilustrações: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
As Tregs mais estudadas são CD4+CD25+FOXP3+. FOXP3 é o fator de transcrição que programa o destino e a função supressora dessas células. Existem mecanismos de tolerância central (no timo) e de tolerância periférica (fora do timo) Tolerância central vs periférica: tolerância central ocorre no timo durante a maturação de células T, onde clones altamente autorreativos são eliminados; tolerância periférica refere-se a mecanismos fora do timo (no organismo adulto) que controlam linfócitos autorreativos remanescentes, incluindo a ação de Tregs. . Sakaguchi e outros demonstraram que parte da população reguladora é gerada no timo, mas que também existem Tregs induzidas na periferia a partir de células T convencionais sob certos sinais (TGF-β, IL-2). Mecanismos de supressão: Tregs usam múltiplos mecanismos Principais mecanismos usados por Tregs: secreção de citocinas anti-inflamatórias (IL-10, TGF-β), expressão de CTLA-4 que modula células apresentadoras de antígeno, captura/consumo local de IL-2 (privando células efetoras), e modulação do microambiente através de enzimas como CD39/CD73 que geram adenosina imunossupressora. — produção de citocinas anti-inflamatórias (IL-10, TGF-β), expressão de CTLA-4 que modula células apresentadoras de antígeno, consumo local de IL-2 (privando outras células), e alteração metabólica do microambiente (ex.: produção de adenosina via CD39/CD73). Estudos de transferência celular, modelos de camundongo com deleção de FOXP3 (fenótipo “scurfy” em camundongos Scurfy: termo usado para descrever o fenótipo de camundongos com deleção do gene Foxp3 — apresentam dermatite, linfoproliferação e autoimunidade grave, e foram um modelo-chave para demonstrar o papel crítico de Foxp3/Tregs em tolerância imunológica. ) e achados clínicos em IPEX (síndrome humana associada a mutações FOXP3) foram cruciais para estabelecer a relação causal.
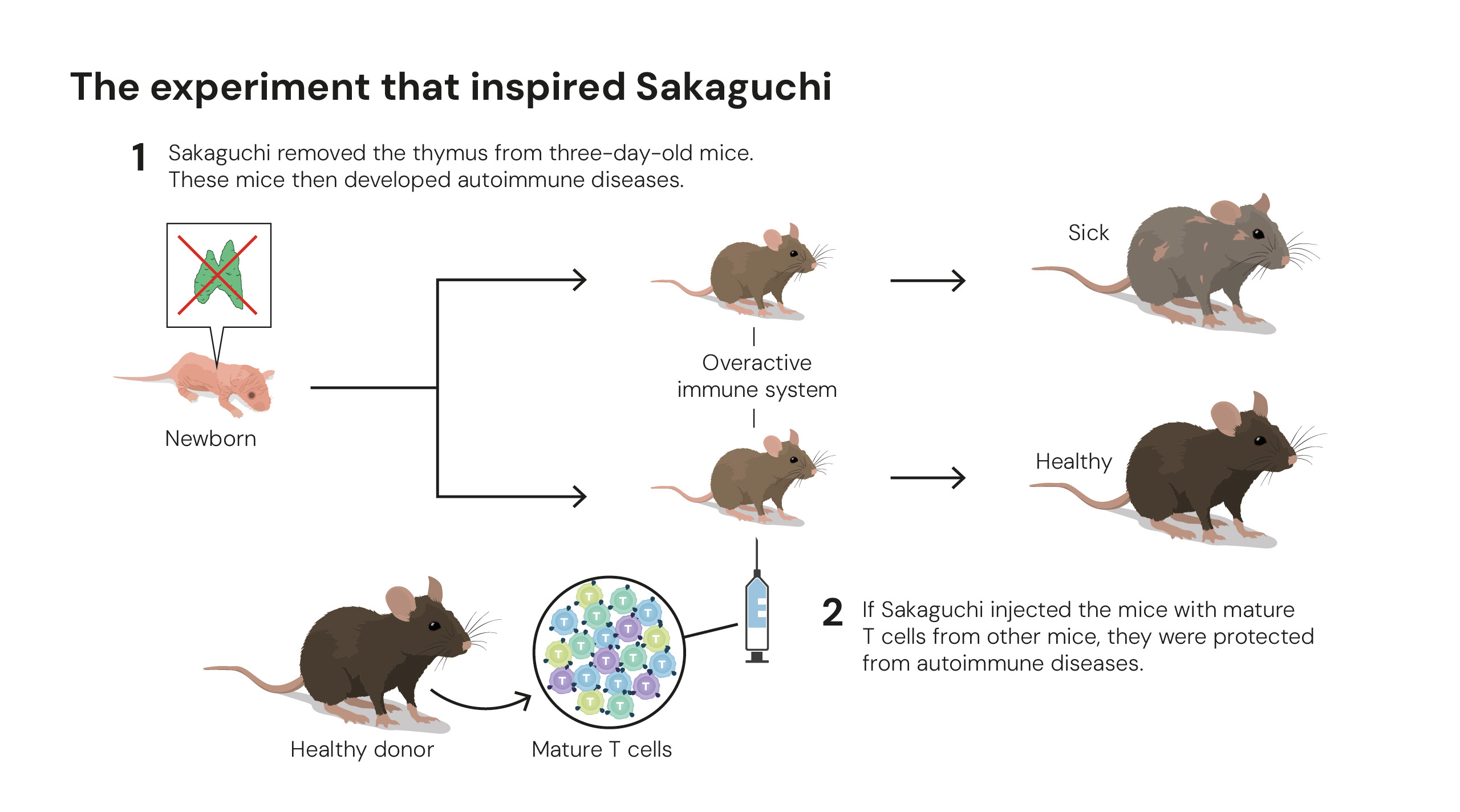
Experimento que inspirou estudos sobre tolerância periférica. Ilustrações: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
Implicações clínicas e aplicações
Autoimunidade: compreender Tregs e FOXP3 permite identificar causas de síndromes como IPEX, além de apontar estratégias para restaurar tolerância em doenças autoimunes (artrite reumatoide, esclerose múltipla, diabetes tipo 1).
Oncologia: tumores frequentemente recrutam ou induzem Tregs para suprimir respostas antitumorais; modular Tregs pode melhorar a eficácia de imunoterapias (checkpoint inhibitors, vacinas).
Transplantes: terapias baseadas em Tregs (infusão de Tregs, protocolos para expandi-las) estão sendo testadas para reduzir rejeição e diminuir o uso de imunossupressores de amplo espectro.
Terapêuticas emergentes: abordagens incluem expansão ex vivo de Tregs, engenharia de Tregs com receptores específicos (CAR-Tregs CAR-Tregs: células T reguladoras geneticamente modificadas com receptores quiméricos de antígeno (CARs) para direcioná-las a alvos específicos — estratégia experimental para induzir tolerância localizada em doenças autoimunes ou transplantes. ), e drogas que modulam vias chave (IL-2 de baixa dose para favorecer Tregs).
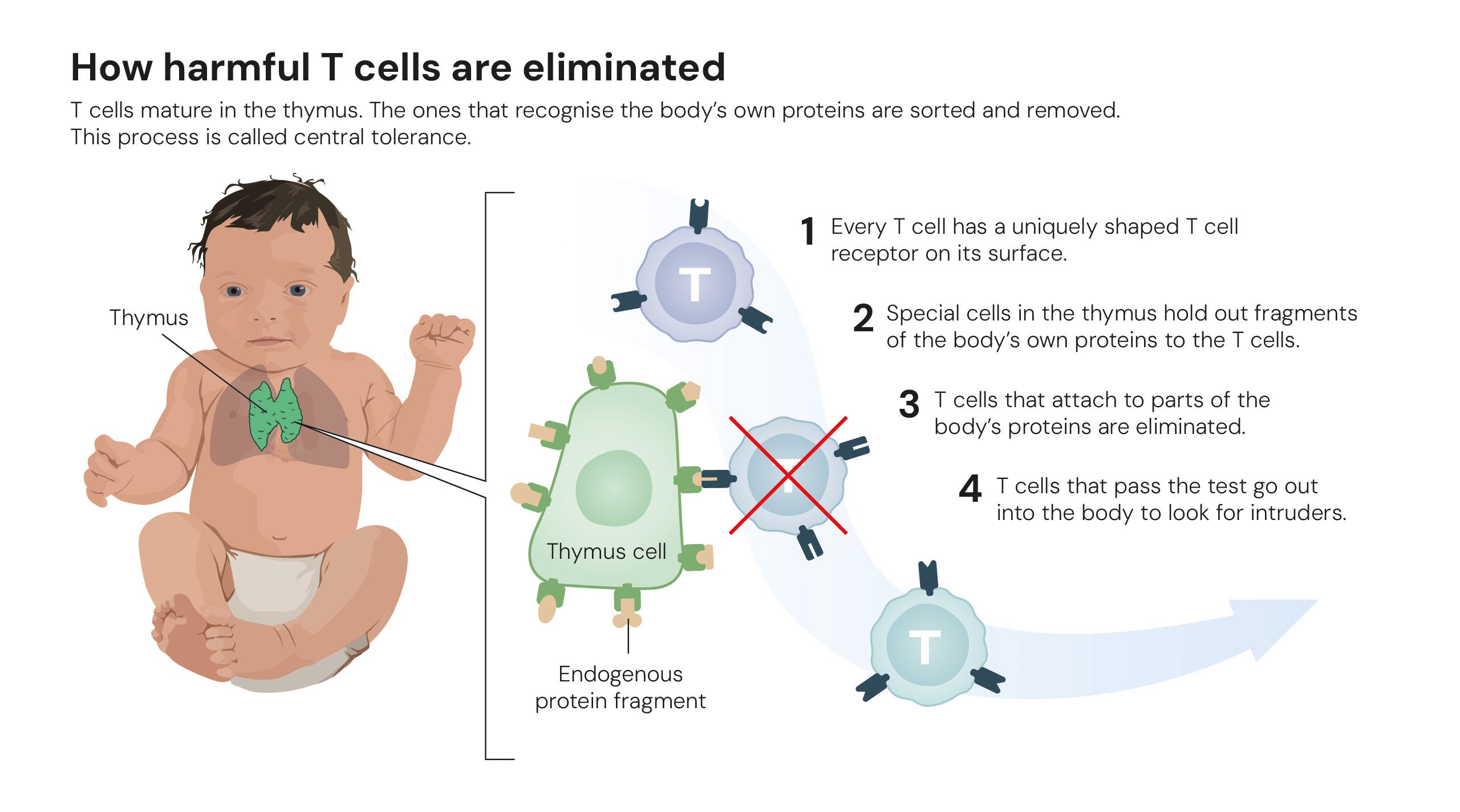
Como células T danosas são eliminadas. Ilustrações: © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén.
Leia mais
A principal fonte desta postagem é o press release da Fundação Nobel e os materiais de apoio publicados pela Nobel Prize Outreach (press release oficial, background científico e resumo para leigos).
Referências
Resumo para leigos, Assembléia do Nobel - em inglês (pdf)
Resumo científico, Assembléia do Nobel - em inglês (pdf)