Medicina de precisão: quando o médico hackeia o paciente
22 Março 2018
Escrito por Francisco H. C. FelixUm jovem casal aguarda com ansiedade a sua primeira entrevista com uma médica a qual foram encaminhados. A consulta anterior com uma pediatra conhecida fora cheia de meias palavras e acompanhada de uma atitude anormalmente séria da médica que já atendia a família há tempos. Alheia a tudo, a criança deles brincava despreocupadamente, como se não estivesse em um hospital. Depois de uma espera que não foi medida em tempo, mas em antecipação, a nova médica, uma oncologista, declara a aterradora notícia para a família: câncer.
Em um instante, a vida deles muda completamente, vira pelo avesso, e tanto o pai quanto a mãe esquecem completamente tudo o que os preocupava até um ou dois dias atrás. Não parece existir mais nada no mundo. Sem ter tempo para nada, o casal é confrontado com informações sobre a doença, da qual nunca ouviram falar, sobre o tratamento, sobre as chances de recuperação. A médica espera que eles decidam junto com ela diante da notícia inesperada e das informações que recebem. Sem chão, o casal apenas quer que algo ou alguma coisa afaste sua criança daquele terrível diagnóstico. Eles não tem idéia nenhuma do que fazer, de como agir.
Para um oncologista pediátrico, essa é uma situação rotineira e difícil. Como abordar uma família para dar tal notícia? Como explicar as opções de tratamento e as chances de recuperação, além de transmitir de forma que leigos possam entender uma grande quantidade de informações sobre modalidades de tratamento, drogas, efeitos adversos, possíveis complicações, e tudo o mais que permeia o tratamento do câncer pediátrico? A medicina moderna tem aperfeiçoado o tratamento do câncer em crianças e adolescentes cada vez mais desde que Sidney Farber Sidney Farber, nascido em 1930 (Buffalo, NY) e falecido em 1973 (Boston, MA), foi um patologista pediátrico, conhecido em sua especialidade por, entre outras descobertas, ter descrito a doença hoje conhecida como Doença de Farber (deficiência de ceramidase). Insatisfeito com a completa falta de opções para o tratamento do câncer pediátrico em sua época, Farber foi o primeiro a completar o desenvolvimento pre-clínico e clínico de uma droga que conseguiu induzir uma remissão em uma criança com leucemia. Por esse feito, foi denominado pai da moderna quimioterapia antineoplásica. tratou seus primeiros pacientes na década de 40, criando a era moderna da quimioterapia anticâncer. Muito do tratamento atual dos pacientes pediátricos com câncer ainda se baseia na visão do Dr. Farber.
O tratamento moderno de leucemia (o câncer mais comum em crianças e adolescentes) até hoje se baseia no uso de drogas antagonistas do folato e corticosteróides, duas inovações introduzidas pela primeira vez pelo Dr. Farber entre o fim dos anos 40 e a década de 60. Igualmente, o tratamento atual do nefroblastoma, ou tumor de Wilms Nefroblastoma, ou tumor de Wilms, é o tumor renal maligno primário mais comum em crianças e adolescentes. Os tumores de Wilms podem ser classificados em dois grupos de acordo com sua histologia (aspecto na biópsia): favorável (contém elementos celulares bem diferenciados) ou anaplástico (contém células pouco diferenciadas). Carl Max Wilhelm Wilms (1867 - 1918), patologista e cirurgião alemão, foi homenageado pelo seu extenso estudo sobre a origem das células neoplásicas e os tumores renais. (um dos tumores sólidos mais comuns em crianças) ainda utiliza a combinação da droga actinomicina D com radioterapia, criada pelo Dr Farber. Muito mudou de lá para cá, todavia.
Como os tratamentos com uma ou duas drogas não conseguiam curar boa parte dos pacientes, inúmeros pesquisadores que se seguiram estudaram a associação dos primeiros tratamentos propostos com outras drogas, a fim de potencializar o efeito dos medicamentos (um fenômeno conhecido por sinergismo, quando uma associação de duas drogas tem efeito maior que a soma de seus efeitos separados). Ao mesmo tempo, um grande esforço de pesquisa básica estudou as bases biológicas do câncer, aumentando o conhecimento sobre todos os tipos de câncer. Nos Estados Unidos, uma política pública de investimento em pesquisa básica e clínica em grande escala foi iniciada pelo governo na década de 70, a chamada “Guerra contra o câncer”.
Devido ao investimento governamental maciço em pesquisa, os EUA tornaram-se logo os líderes mundiais na pesquisa do câncer. Na década de 80, já se sabia que o câncer não é uma doença apenas, mas um grande e diverso grupo de doenças e que tratar todos os pacientes da mesma forma não era inteligente. Já existiam tratamentos adaptados para cada tipo de câncer e até para subtipos, grupos de pacientes com risco diferente de acordo com as características biológicas da doença. Hoje sabe-se que a leucemia em crianças e adolescentes não é uma doença única, compreendendo pelo menos cinco tipos principais e dezenas de subtipos separados por características celulares e moleculares.
Isso possibilitou a modificação do tratamento para subtipos específicos de leucemia. Por exemplo, hoje em dia o subtipo leucemia promielocítica é tratado de forma diferente dos demais subtipos de leucemia pediátrica, com melhores resultados do que anteriormente. Graças à utilização dos novos conhecimentos sobre biologia do câncer e farmacologia das drogas anticâncer, os resultados do tratamento da leucemia em crianças e adolescentes melhoraram substancialmente nas últimas décadas. Da década de 40, antes da revolução de Farber, quando os pacientes com leucemia eram tratados com transfusões e cuidados de enfermagem e viviam poucas semanas, chegamos a uma probabilidade de cura maior que 90% para a maioria das crianças e adolescentes com leucemia linfóide aguda diagnosticadas nos EUA.
Nos últimos anos, uma nova revolução está ocorrendo no conhecimento sobre o câncer, com um impacto potencial no tratamento. Desde que o Projeto Genoma Humano Projeto Genoma Humano (PGH): consórcio internacional que chegou a envolver mais de 5000 pesquisadores de 50 países, reunidos com o intuito de sequenciar todo o genoma (conjunto de genes) humano. O projeto, planejado desde os anos 80, iniciou em 1990, sob a direção de James D. Watson (um dos descobridores da estrutura do DNA) como um programa do Department of Energy (DOE) e National Institutes of Health (NIH) americanos, prevendo que levaria 15 anos e gastaria 3 bilhões de dólares para sequenciar cerca de 100 mil genes. Em 2003, num comunicado de imprensa conjunto, foi anunciada a conclusão oficial do projeto, o qual sequenciou 99% do genoma humano com uma precisão de 99,99%, encontrando cerca de 22300 genes, muito menos do que o esperado inicialmente. foi concluído há 15 anos atrás, esforços em vários países têm elucidado o Genoma do Câncer. Recentemente, o mapa genômico da leucemia da infância e adolescência foi estudado em detalhes. Os novos conhecimentos sobre genômica (estudo do conjunto completo de genes de organismos) podem conduzir à individualização do tratamento dos pacientes com câncer. De um começo no qual todos os pacientes com câncer eram tratados da mesma forma, estamos chegando a uma era onde cada paciente vai ser tratado de uma maneira particular.
Isso ocorrerá porque estamos começando a conhecer as mutações genéticas que conduzem ou dirigem o câncer (driver mutations) e estamos desenvolvendo maneiras de bloquear ou reverter estas mutações. Nos últimos anos, já estamos começando a ver a aprovação e utilização de novas drogas que não são usadas contra um tipo de câncer, mas contra um tipo de mutação que pode ocorrer em vários tipos de câncer. Por exemplo, a medicação imatinibe é usada para tratar pacientes com doenças bem diferentes entre si, como leucemia mielóide crônica, leucemia mielomonocítica crônica, subtipos de leucemia linfóide aguda, tumor estromal gastrointestinal, síndrome hipereosinofílica, dermatofibrossarcoma protuberante, neurofibroma plexiforme, além de outras em pesquisa.
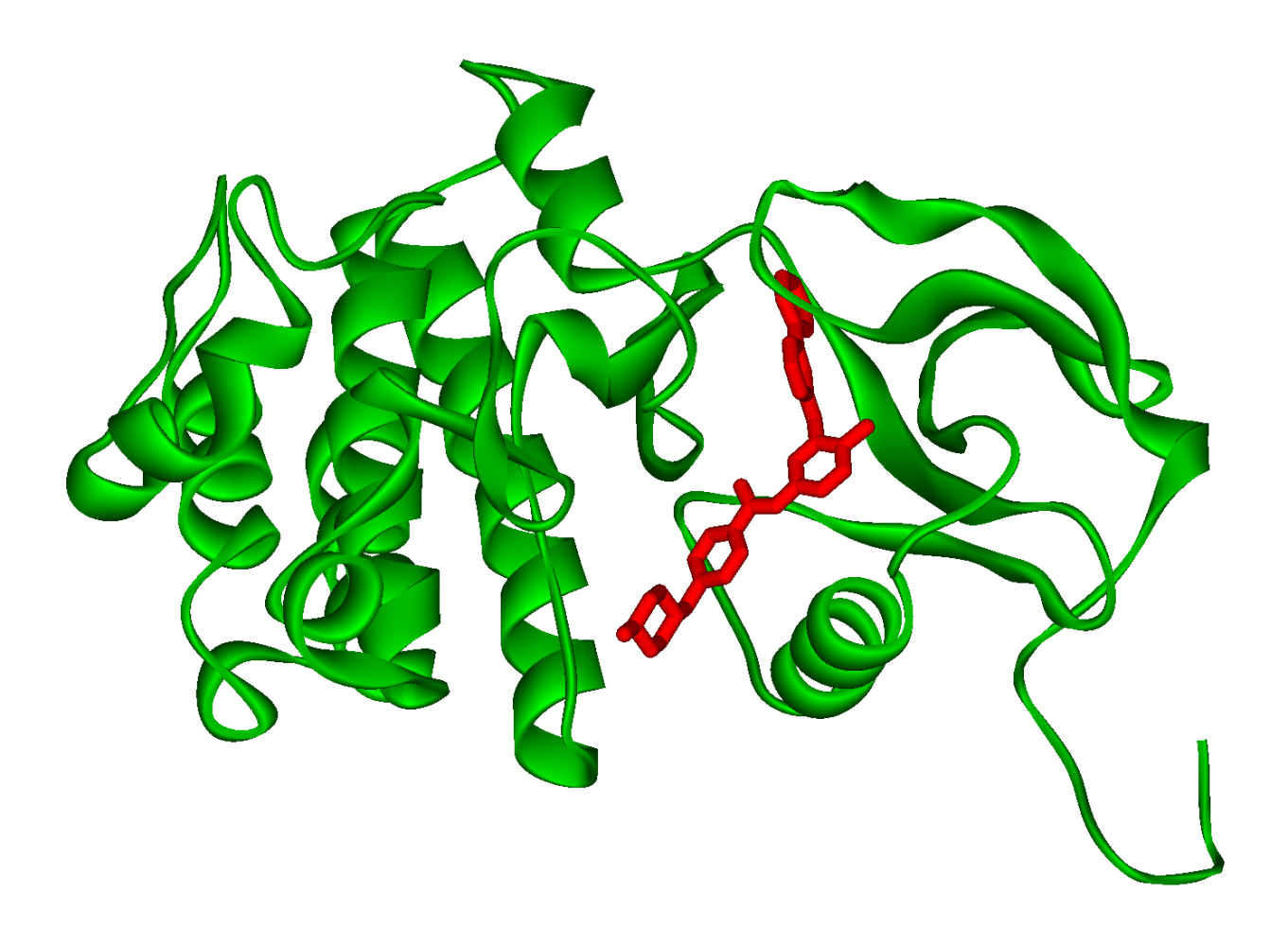 Figura esquemática do imatinibe ligado à seu alvo molecular na Leucemia Mielóide Crônica, a proteína mutante bcr-abl. Fonte: Fvasconcelos, domínio público.
Figura esquemática do imatinibe ligado à seu alvo molecular na Leucemia Mielóide Crônica, a proteína mutante bcr-abl. Fonte: Fvasconcelos, domínio público.
Essa é uma importante mudança de paradigma e marca o início de uma nova época do tratamento do câncer. No futuro, não trataremos mais os tumores, mas as mutações genéticas que os criam e mantém. Ainda não chegamos nesse ponto e, provavelmente, falta um longo caminho até lá. Mas já estamos no início dessa trilha. Há poucos dias, um ensaio de Steven J. Katz no Journal of American Medical Association mostrou como as evidências científicas estão sendo usadas para, pouco a pouco, reduzir a quantidade de tratamento quimioterápico que pacientes com câncer de mama recebem. O Dr. Katz mencionou que o tratamento atual do câncer de mama é um dos melhores exemplos do que se denomina medicina de precisão (precision medicine), onde o médico usa o conhecimento sobre a doença e o paciente para melhorar o tratamento e a qualidade de vida.
Como exemplo, ele citou que pacientes com câncer de mama sem metástases linfonodais, receptor hormonal positivo (tumores que respondem ao estrógeno, hormônio feminino) e ERBB-2 negativos (tumores sem mutações desse gene condutor), com tumores menores que 2 cm, podem deixar de receber quimioterapia convencional. Essa é uma decisão que sempre deve ser tomada caso a caso por um oncologista experiente, pois faz parte da medicina personalizada, ou como tratar cada paciente de forma individual, de acordo com as características biológicas do tumor e o perfil do paciente. Esse tipo de abordagem já está sendo usado para (1) reduzir a intensidade do tratamento quando isso é possível, (2) melhorar a qualidade de vida do paciente e (3) otimizar os resultados do tratamento.
Decidir quando reduzir a intensidade do tratamento do câncer, aliás, é um problema que envolve múltiplos componentes. Voltemos ao exemplo inicial, o de um casal que recebe a notícia dessa doença em sua criança. Como o casal lidaria com a informação da possibilidade de fazer um tratamento menos intensivo? Nem sempre essa decisão seria linear. Por exemplo, recentemente descobriu-se que subgrupos de pacientes pediátricos com meduloblastoma (o câncer cerebral mais comum em crianças e adolescentes) podem ser tratados com redução da intensidade da radioterapia, o que reduziria a chance de efeitos colaterais a longo prazo. Utilizar essa abordagem, no entanto, pode ter alguns riscos adicionais, pois envolve o tratamento com quimioterapia anticâncer durante meses. Além disso, existem subgrupos de pacientes com meduloblastoma que poderiam ser tratados com redução maior ainda da intensidade do tratamento, alguns sem radioterapia e alguns com redução da quantidade de quimioterapia.
Mais uma vez, essa é uma decisão difícil que precisa da participação de um oncologista experiente e suscita ansiedade na equipe e na família. Uma das manifestações comuns tanto da família quanto da equipe médica é a antecipação do arrependimento, quando, por exemplo, o medo do tratamento falhar ou um caso recente de falha de outro paciente (mesmo que com perfil diferente) levam família e equipe a escolherem a maior intensidade de tratamento.
Nesses casos, a medicina de precisão apóia o processo de decisão com as informações necessárias, vindas da pesquisa clínica de qualidade. Assim, novos conhecimentos podem aumentar a certeza e diminuir a incerteza sobre a decisão de tratamento em cada caso. O avanço da pesquisa clínica, dessa forma, promove melhores resultados, melhor qualidade de vida e menos intensidade de tratamento para os pacientes, com benefício de todos. Essa é a tendência moderna do tratamento oncológico clínico como um todo e também da oncologia pediátrica.